氨基酸
蛋白质是生物体内含量最高、功能最重要的生物大分子,与多糖、脂类和核酸等都是构成生命的基础物质。
多肽是氨基酸以肽链连接在一起而形成的化合物,它也是蛋白质水解的中间产物。除了作为蛋白质代谢的中间产物外,生物体内还存在一些重要的活性肽,它们通过神经-内分泌等各种作用途径,行使其微妙的传讯功能,是沟通细胞与器官间信息的重要化学信使。
氨基酸(amino acid)是一类分子中既含有氨基又含有羧基的化合物。根据氨基和羧基的相对位置,氨基酸可分为α、β、γ等类型。虽然己发现几百种天然氨基酸,但是蛋白质水解后的氨基酸主要有20种。
不同来源的蛋白质在酸、碱或酶的作用下,能逐步水解,最终产物是不同α-氨基酸的混合物。α-氨基酸是组成蛋白质的基本单位。
一、结构、分类和命名
组成蛋白质的20种氨基酸,除脯氨酸为α-亚氨基酸外,均属α-氨基酸,即其氨基和羧基都连接在α-碳原子上,其结构通式如下(式中R代表不同的侧链基团):
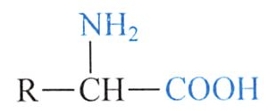
由于氨基酸分子内同时存在酸性基团(-COOH)和碱性基团(-NH2),它们可相互作用形成内盐。因此氨基酸的物理性质与一般有机化合物不同,多为无色晶体,熔点一般在200℃以上,且较易溶于水而难溶于非极性溶剂。
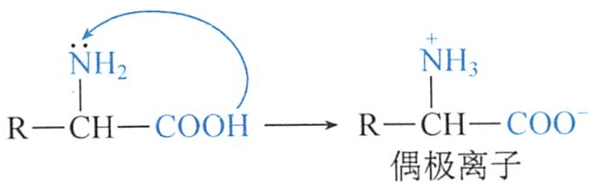
固态氨基酸分子中的羧基和氨基均呈离子状态。固态氨基酸以偶极离子(dipolar ions)的结构形式存在。
除甘氨酸外,其他组成蛋白质的氨基酸分子均具有旋光性,其α-碳原子为手性碳原子。氨基酸的构型通常采用D、L命名法,即以甘油醛为参考标准,在Fischer投影式中,凡氨基酸分子中-NH3的位置与L-甘油醛手性碳原子上一OH的位置相同者为L-型,相反者为D-型:
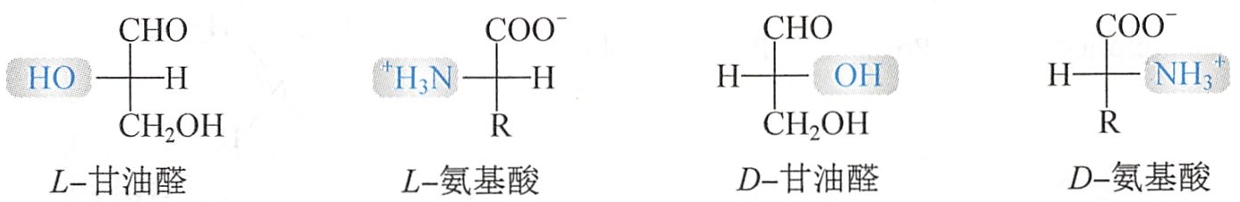
构成蛋白质的α-氨基酸均为L构型。若用R、S标记法,其α-碳原子除半胱氨酸为R构型外,其余皆为S构型。这是因为在半胱氨酸中,CH2SH的取代基位次高于COOH。
根据α-氨基酸分子中R基团的结构和性质,氨基酸有不同的分类方法。如按R基团的结构可分为脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。
在医学上,一般根据α-氨基酸在生理pH范围内(pH=7.35)其侧链R基团的极性及其所带电荷的不同,分为4类(表17-1)。
- 第一类是R为非极性或疏水性基团的氨基酸,它们通常埋藏于蛋白质分子内部。
- 第二类是R为极性但不带电荷基团的氨基酸,其侧链中含羟基、巯基等极性基团,在生理pH状况下不带电荷(在碱性溶液中,酚羟基和巯基可给出质子而带负电荷),并具有一定的亲水性,往往分布在蛋白质分子的表面;
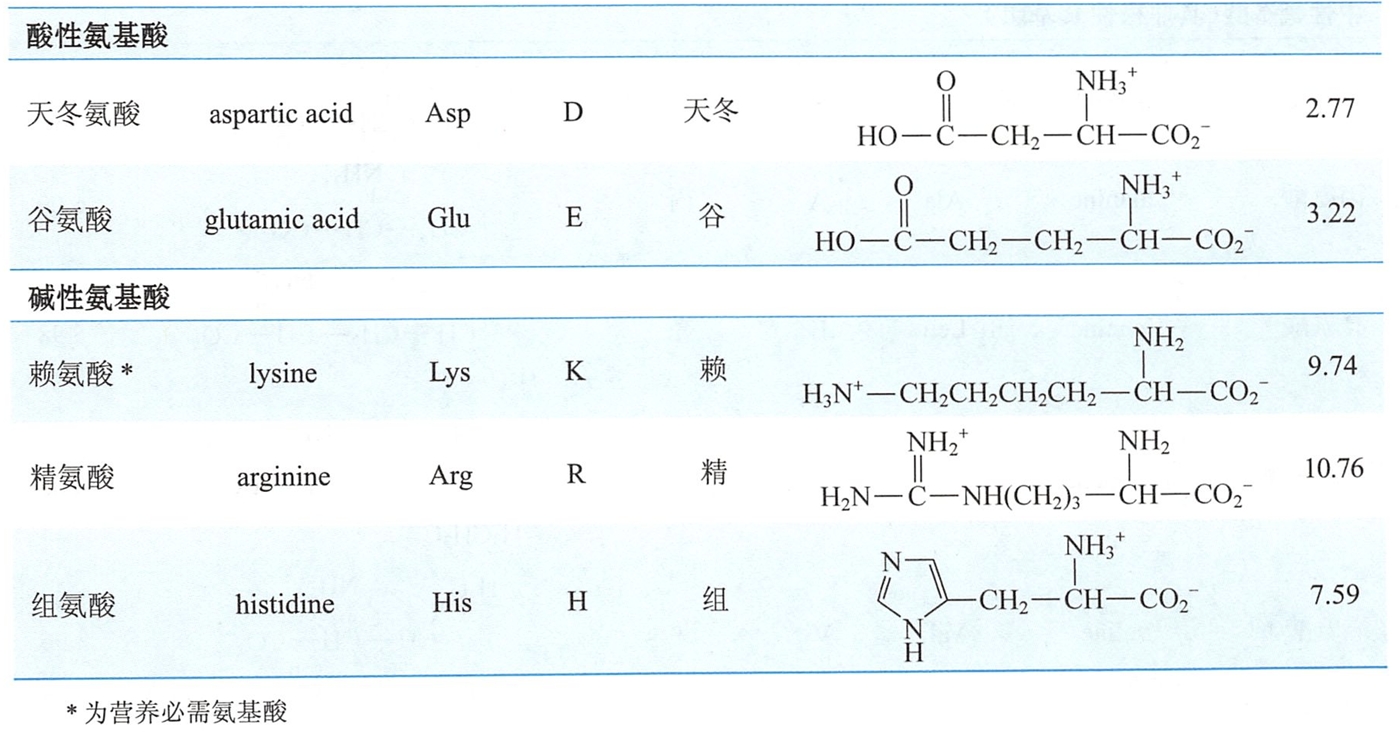
- 第三类是酸性氨基酸。在生理pH状况下,其侧链中带有已给出质子的-COO-。
- 第四类是碱性氨基酸,其侧链中带有易接受质子的胍基、氨基、咪唑基等基团,它们在中性和酸性溶液中往往带正电荷。
蛋白质基本单位:20种L-α-氨基酸
- 酸性氨基酸(负电,极性):天冬氨酸(Asp)、谷氨酸(Glu)
- 碱性氨基酸(正电,极性):赖氨酸(Lys)、精氨酸(Arg)、组氨酸(His)
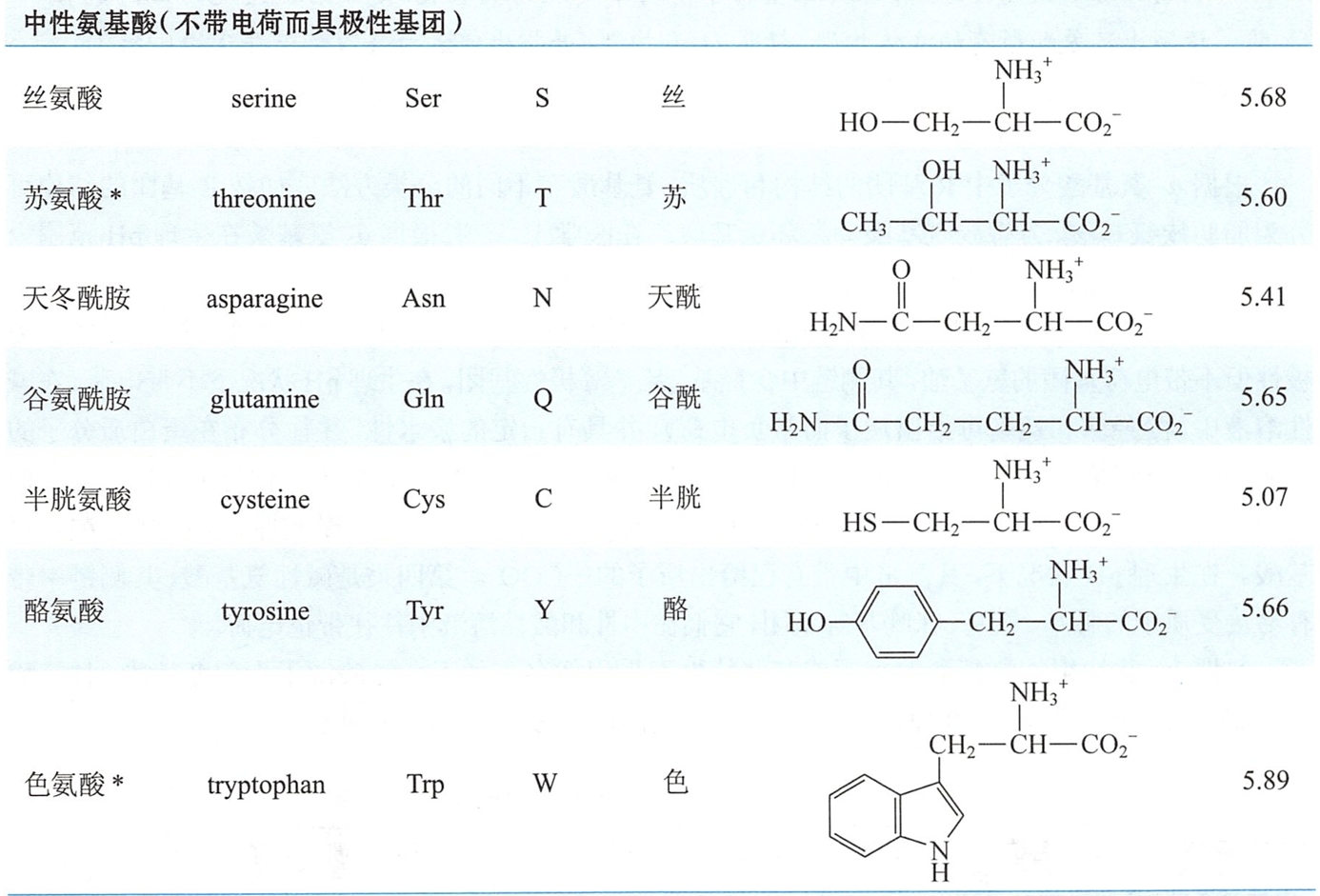
- 中性氨基酸(极性):甘氨酸(Gly)、丝氨酸(Ser)、苏氨酸(Thr)、半胱氨酸(Cys)、酪氨酸(Tyr)、天冬酰胺(Asn)、谷氨酰胺(Gln)
- 丝氨酸、苏氨酸、酪氨酸的羟基,羟脯氨酸、羟赖氨酸
- 磷酸化:蛋白激酶(ATP为磷酸基团供体),酸性氨基酸也可以
- 去磷酸化:蛋白磷酸酶
- 丝氨酸、苏氨酸、酪氨酸的羟基,羟脯氨酸、羟赖氨酸
- 中性氨基酸(非极性):丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、脯氨酸(Pro)、苯丙氨酸(Phe)、色氨酸(Trp)、蛋氨酸(Met)
第一类和第二类氨基酸因其分子中各含一个-NH3+和-COO-,习惯上又称为中性氨基酸。但这类氨基酸由于酸性解离大于碱性解离,故其水溶液pH略小于7,大多呈微酸性。
习惯上,往往根据氨基酸的来源或某些特性而采用俗名。如天冬氨酸源于天门冬植物,甘氨酸因具甜味而得名。常见的20种-氨基酸的名称、结构及中英文缩写符号见表17-1。
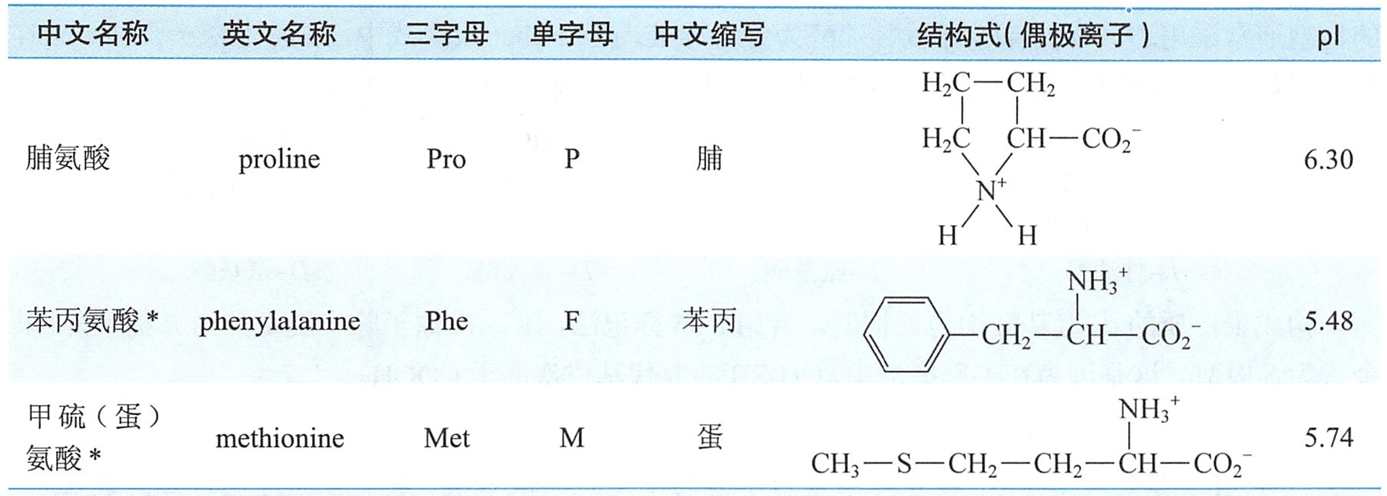
- 有些氨基酸在人体内不能合成或合成数量不足,必须由食物蛋白质补充才能维持机体正常生长发育,这类氨基酸称为营养必需氨基酸(essential amino acid),主要有8种。
- 此外,组氨酸和精氨酸在婴幼儿和儿童时期因体内合成不足,也需依赖食物补充一部分。
- 早产儿还需要适当补充色氨酸和半胱氨酸。
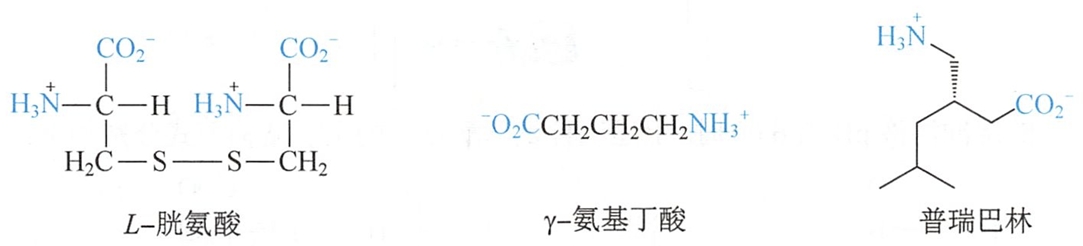
蛋白质分子中含有一些经修饰的氨基酸,其在生物体内均无相应的遗传密码,往往在蛋白质生物合成前后,由其中相应氨基酸经加工修饰而成,如胱氨酸是由两分子半胱氨酸氧化而成。
植物、细菌和动物体内还发现大量非蛋白质氨基酸,它们大多为α-氨基酸的衍生物,也有些是β-氨基酸、 γ-氨基酸或δ-氨基酸,还发现有D-型氨基酸。
- 如鸟氨酸和瓜氨酸是精氨酸的代谢中间体。 #生化
- β-丙氨酸是构成泛酸的基本成分。
- 脑内存在的重要神经递质γ-氨基丁酸是谷氨酸的脱羧产物。 #生理
- 普瑞巴林(pregabalin)是一种人工合成的一种钙离子通道调节剂,属于γ-氨基丁酸衍生物,临床上主要用于治疗外周神经痛和癫痫。 #药理
二、性质
(一)酸碱性和等电点
固态氨基酸以偶极离子形式存在。由于氨基酸分子内有两个可解离的基团(-NH3+和-COO-),因此氨基酸在水溶液中存在阳离子、阴离子和偶极离子三种结构形式,且呈平衡状态。
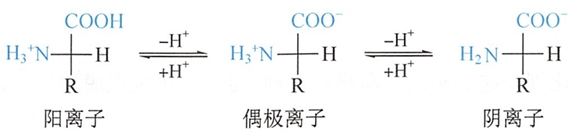
由于氨基酸分子中给出质子的酸性基团和接受质子的碱性基团的数目和能力各异,不同的氨基酸在水溶液中呈现不同的酸碱性。由于-NH3+给出质子的能力大于-COO-接受质子的能力,因此中性氨基酸水溶液呈弱酸性。
(补充:能给电子从而失去电子是碱性,即自身升失氧。失去电子后变弱酸,因为倾向于得电子。能得电子从而得到电子是酸性,即自身降还得。得到电子后变弱碱,因为倾向于给电子。)(另一种酸碱理论是质子得失,比较简单。)
不同的氨基酸在溶液中主要带何种电荷,取决于溶液的pH。当调节某一种氨基酸溶液的pH值使该种氨基酸解离成阳离子和阴离子的趋势及程度相等,即刚好以偶极离子形式存在,此溶液的pH值称为该氨基酸的等电点(isoelectric point,pI)。
等电点时,氨基酸所带的净电荷为零,整体呈电中性,在电场中,既不向负极移动,也不向正极移动。当氨基酸溶液的pH大于pI时(如加入碱),有利于“-NH3+”的解离,使溶液中的氨基酸带负电荷的占优势。反之,当溶液的pH小于pI时(如加入酸),有利于“-COO-”与“H+”结合,使溶液中的氨基酸带正电荷的占优势。
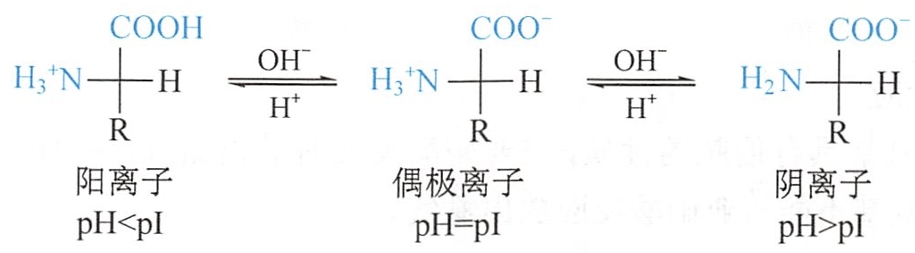
各种氨基酸由于其组成和结构不同,因此具有不同的等电点。
- 酸性氨基酸水溶液的pH值小于 7,所以必须加入较多的酸才能使正负离子量相等,等电点约为3。
- 反之,碱性氨基酸水溶液中正离子较多,则必须加入碱,才能使负离子量增加。所以碱性氨基酸的等电点大于7,在7.6~10.8。
- 中性氨基酸的等电点小于7,一般在5.0~6.5之间。
常见的20种氨基酸的等电点列于表17-1。
带电颗粒在电场中总是向其电荷相反的电极移动,这种现象称为电泳(electrophoresis)。由于各种氨基酸的相对分子质量和pI不同,在相同pH的缓冲溶液中,不同的氨基酸不仅带电荷状况有差异,而且在电场中的泳动方向和速率也往往不同。
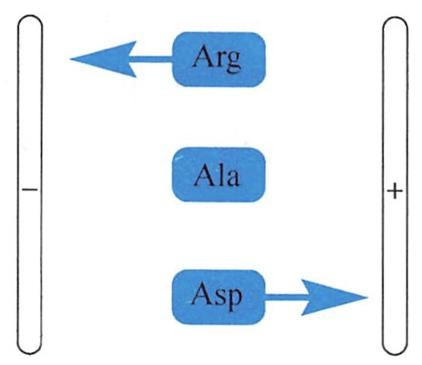
基于这种差异,可用电泳技术分离氨基酸的混合物。例如将丙氨酸、天冬氨酸和精氨酸的混合物置于电泳支持介质(滤纸或凝胶)中央,调节溶液的 pH值至6.00(为缓冲溶液)时,此时精氨酸(p=10.76)带正电荷,在电场中向负极泳动;而天冬氨酸(pI=2.77)带负电荷,向正极泳动;丙氨酸(p=6.00)在电场中不泳动,藉此可将三者进行分离。
(二)脱羧反应
氨基酸与氢氧化钡一起加热或在高沸点溶剂中回流,可发生脱羧反应,失去二氧化碳而得到少一个碳的胺:
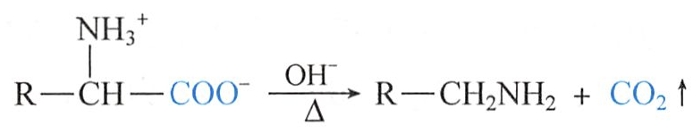
生物体内的脱羧反应是在某些酶的作用下发生的。 #生化
- 例如,蛋白质腐败时,精氨酸或鸟氨酸可发生脱羧反应生成腐胺[H2N-(CH2)4-NH2];
- 赖氨酸脱羧可得尸胺[H2N-(CH2)5-NH2]。
- 肌球蛋白中的组氨酸在脱羧酶的存在下,可转变成组胺,机体中组胺过量易引起过敏反应。人食入了不新鲜的鱼,有时会发生过敏,这可能就是由于机体内产生了过量的组胺所致。
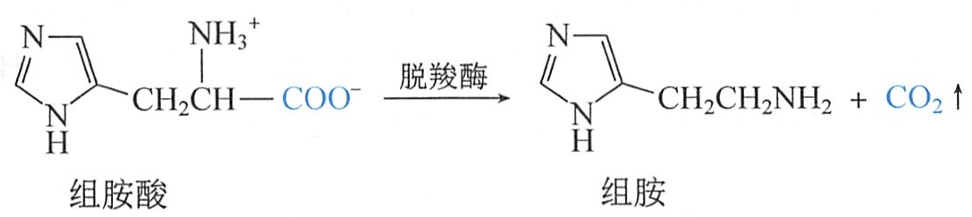
(三)与亚硝酸反应
氨基酸分子中的氨基具有伯胺的性质,与亚硝酸反应时放出氮气,-NH3+被羟基取代,生成α-羟基酸。脯氨酸的亚氨基不能与亚硝酸反应放出氨气。
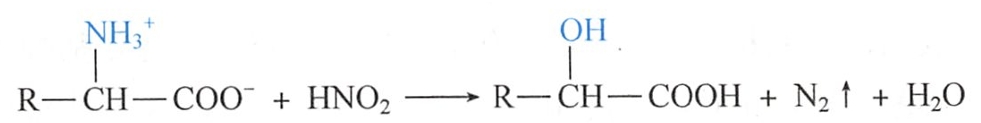
释放的N2中一半的氮原子来自氨基酸。若定量测定反应中所释放出的N2体积,即可计算出氨基酸的含量。
因此,利用该反应可以测定蛋白质分子中的游离氨基或氨基酸分子中的氨基含量,此种方法称为van Slyke氨基氮测定法,常用于氨基酸和多肽的定量分析。
(四)与茚三酮的显色反应
氨基酸与茚三酮的水合物在乙醇(或丙酮)溶液中共热,可生成蓝紫色的化合物。
α-氨基酸与茚三酮的水合物在乙醇或丙酮溶液中共热,首先被氧化分解形成醛、氨和二氧化碳,茚三酮则被还原为仲醇。水合茚三酮再与所生成的仲醇、氨结合,生成具有蓝紫色的化合物,称为罗曼紫(Ruhemann's purple)。法医学上该反应被用于鉴定指纹。
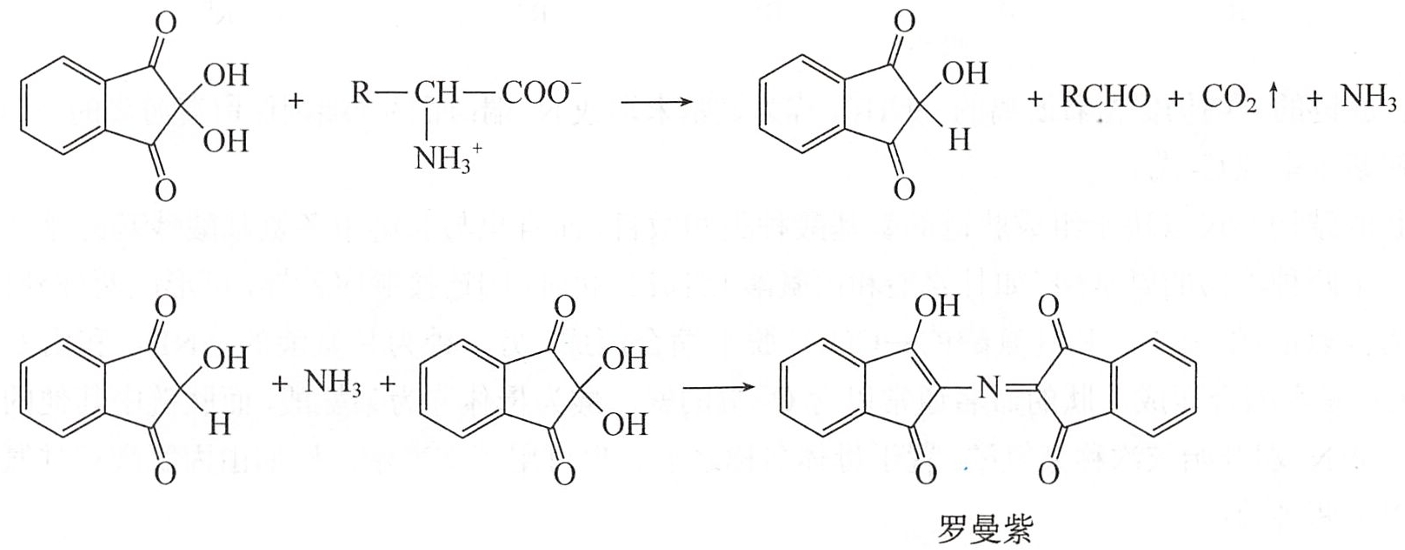
反应产生的蓝紫色在570nm有强吸收,其吸收强度与氨基酸的含量成正比,因此可用于氨基酸的定量分析。
亚氨基酸(脯氨酸和羟脯氨酸)与茚三酮的反应呈黄色。茚三酮反应广泛用于肽和蛋白质的鉴定或纸层析与薄层层析等的显色。
(五)络合性质
氨基酸中羧基可以与金属成盐,而氨基上的氮原子由于具有孤电子对,同时也可以与金属离子形成配位键,形成稳定的络合物。
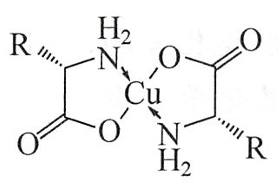
例如,在一定条件下,氨基酸可以与二价铜离子形成蓝色络合物结晶。该方法常用于分离或鉴定氨基酸。
(六)紫外吸收性质
酪氨酸、苯丙氨酸和色氨酸等芳香族氨基酸在280nm处有最强的紫外吸收峰。由于大多数蛋白质含有这些氨基酸残基(amino acid residue),氨基酸残基数与蛋白质含量成正比,故通过对280nm波长的紫外吸光度的测量可对蛋白质溶液进行定量分析。